TUMOR OTAK: ASTROCYTOMA
Astrocytoma merupakan salah
satu tumor spontaneous pada sistem syaraf yang berasal dari neuroglia yang
paling sering terjadi pada tikus putih. Berdasarkan tipenya, astrocytoma dapat
diklasifikasikan menjadi 4 yaitu fibrillary, protoplasmic, pilocytic, dan
malignant (Yamate et al., 1987).
Menurut WHO, klasifikasi astrocytoma
atau tumor astrositik pada manusia berdasarkan gambaran histologinya dibagi
menjadi 4 kelas yaitu: kelas I (pilocytic astrocytoma), kelas II (diffuse
astrocytoma), kelas III (anaplastic astrocytoma), dan kelas IV
(glioblastoma).Tumor Kelas III dan IV dianggap sebagai malignant glioma.Seiring
bertambanhan umur dan progress penyakit, tahapan astrocytoma ini dapat
berkembang dri kelas 1 menjadi kelas 4 yang dikenal sebagai malignant glioma
(Louis et al., 2007).
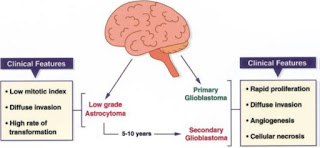
Gambar 1. Gambaran klinis perubahan asrocytoma dari
kelas I hingga ketahapan yang lebih berat yaitu secondary glioblastoma atau
kelas IV yang lebih dikenal sebagai malignat glioma pada manusia (Maher et al.,
2001).
Tabel 1. Perubahan secara histologi yang terbentuk sebagai
gambaran progresif tumor otak dari kelas I hingga kelas IV pada manusia seiring
bertambahan umur dan perubahan gene yang terjadi (Maher et al.,
2001).
Tabel 2. Perubahan ekspresi gene yang terjadi dari
perkembangan astrocytoma kelas I menjadi
kelas IV (yang dikenal sebagai malignat glioma) pada manusia (Wen dan
Kesari, 2008).
Perbandingan tumor spontaneous malignant glioma
(astrocytoma kelas IV) pada tikus dengan kejadian pada manusia
Malignant astrocytoma pada
tikus merupakan jenis tumor otak yang sering diteliti untuk mempelajari
glioblastoma multiform atau malignat glioma pada manusia (Leestma, 1980).
Berikut adalah perbandingan kejadian malignat glioma pada tikus dan manusia
berdasarkan patologi dan analisa perubahan gene yang terjadi sebagai berikut:
1. Gambaran patologi
Menurut Jortner dan Percy
(1978) dan Leestma (1980), gambaran histopatologi tumor neuroglia pada manusia
dan hewan laboratorium adalah mirip. Pada
tikus, malignant glioma menunjukkan
gambaran sel-sel neoplastik yang mengambil alih dan menginfiltrasi
parenkim otak dengan bentuk
nukleus sel yang pleomorphik dan sedikit sel-sel glial yang terdiferensiasi, dengan
nukleus yang besar dan dikarakteristikkan dengan adanya gambaran
mitotik, serta infiltrasi neutrofil. Area nekrosis dan pembuluh darah dengan
sel endothel yang berproliferasi terlihat jelas (Kim et al., 2005). Karakteristik morfologi maglinant glioma pada tikus ini
konsisten dengan yang dilaporkan pada manusia (Kleihues dan Cavenee, 2000).
Gambar 2. Histopatologi malignat glioma pada tikus dan
manusia. (A) Malignat glioma pada
tikus dengan gambaran sel neoplastik
tersusun difus / menyebar, sel sedikit diferensiasi, pleomorphik dan mengandung inti yang besar (panah
panjang) dan gambaran mitotik (panah merah), selain itu juga terdapat area
nekrosis dan proliferasi selsel endothelial. (B) Malignant glioma pada manusia dengan gambaran nuclear pleomorphism, kepadatan seluler yang tinggi,
gambaran mitotik (panah merah), nekrosis, angiogenesis, proliferasi endothelial
vaskuler (panah putih) (Kim et al.,
2000; Wen dan Kesari, 2008).
2. Analisa perubahan gene
Analisa perubahan gene pada tumor spontaneous
malignant glioma pada tikus memiliki
perbedaan dengan kejadian pada manusia (Kim et
al., 2005) sehingga membuat tumor spontaneous tidak begitu baik bila
digunakan untuk mempelajari mekanisme tumor pada manusia.
Kim et al.
(2005) menganalisa ekpresi gene pada kejadian tumor spontaneous malignant glioma
pada mencit kontrol (tanpa perlakuan) pada penelitian karsinogenik
1,3-butadiene. Analisa dilakukan pada gene-gene yang berperan dalam kejadian
tumor pada manusia seperti tumor suppresor gene p53 dan protooncogen Ras. Hasil
menunjukkan pada tumor otak spontaneous tikus tidak terlihat adanya mutasi pada
gene p53 maupun mutasi Ras. Bila dibandingkan dengan kejadian tumor otak pada
manusia, gene p53 dan Ras pada manusia sering mengalami mutasi yang menyebabkan
kejadian dan mendukung perkembangan tumor. Berikut adalah peranan p53 dan Ras
pada kejadian kanker:
a) p53
p53 merupakan protein yang berperan tumor suppresor gene yang menjadi
transkripsi faktor dalam cell cycle
arrest, apoptosis, perbaikan DNA saat sel mengalami kerusakan (Levine et al., 2005).
Gambar 3. Aktivitas p53. (A)
Pada kondisi normal, p53 yang diekspresikan di nukleus aktivitasnya rendah
karena ia akan diikat oleh MDM2 untuk di bawa ke proteosome dan didegradasi. (B) Namun bila ada kerusakan DNA
seperti mutasi Ras, MDM2 akan diikat
oleh p14/ARF sebagai kompensasi tubuh terhadap kondisi yang tidak normal,
sehingga p53 bebas dari MDM2 untuk diproteolisis, dan ekpresi maupun aktivitas
p53 dapat meningkat (Momand et al.,
2005).
Gambar 4. Peranan p53 sebagai transkripsi faktor untuk
menghasilkan protein-protein yang berperan dalam cycle arrest, apoptosis, maupun perbaikan DNA (Levine et al., 2005; Flores dan Jack, 2005).
Mutasi pada gene tp53 biasanya
ditemukan pada sel tumor. Mutasi ini menyebabkan protein p53 yang dihasilkan
bersifat mutan. Protein p53 mutan akan mengalami mutasi pada bagian DNA binding
domain (DBD) merupakan bagian penting bagi p53 untuk dapat berikatan dengan
sequence gene sehingga mutasi pada DBD menyebabkan protein p53 tidak mampu
berikatan dengan sequence target sehingga fungsi p53 sebagai transkripsi faktor
untuk menghasilkan protein-protein yang berperan dalam cycle arrest, apoptosis, maupun perbaikan DNA tidak dihasilkan.
Akibatnya kerusakan tidak dapat diperbaiki, sel yang rusak tidak diapoptosis,
dan siklus sel dapat masuk ke fase S, terjadi
replikasi dan seterusnya hingga terjadi proliferasi sel tumor (Sigal dan
Rotter, 2005).
b) Ras
Pada sel normal mamalia, protooncogene Ras terdiri dari Ras H, K, dan N yang berperan dalam pertumbuhan dan diferensiasi
sel, mengkode suatu protein yang berperan dalam transduksi sinyal yang berperan
yang mengubah secara reversibel nukleotida guanin yang memiliki aktivitas
intrinsik GTPase (Barbacid, 1987; Adari et
al., 1988).
Pada malignant glioma terjadi mutasi pada Ras dan mutasi
ini menyebabkan ras over ekpreasi. Mutasi pada kodon 12, 13, 61 mengubah gen ras menjadi oncogene
yang aktif mengalami amplifikasi (Barbacid, 1987). Over-ekspresi ras
berpotensial menyebabkan transformasi yang berperan dalam perkembangan
neoplasia. Mutasi kodon 61 berperan penting dalam perubahan konformasi protein
ras. Ras yang mutan dapat mengkatalisis GTP hydrolysis (GTPase-inhibiting mutation). Protein mutan ini juga dapat mengikat
GTPase-activating protein yang memediasi efek transduksi sinyal protein ras ke
sel. Protein ras mutan yang mengikat GTP meneyabbakn ikatan irreversibel
sehingga tidak bisa kembali ke bentuk statis GDP atau tetap di bentuk aktif
GTP. Hal ini menyebabkan timbulnya sinyal pertumbuhan yang konstan dan sel
terus berproliferasi (McCormick,
1989).
Gambar 5. Aktivitas oncogen seperti
ras akan memicu INK4a/p16 dan ARF. INK4a/p16 akan menghambat CDK4/D1 sehingga
menghambat fosforilasi Rb, dan ARF akan menghambat MDM2 sehingga menghambat
degradasi p53. Akibatnya sel mengalami perhentian sementara atau dapat juga
terjadi apoptosis yang menunjukkan sebagai respon antiproliferasi. Namun bila
ada stimulus oncogen tapi gen p53 dan
INK4a/p16 mengalami mutasi, maka
tidak terjadi penahanan siklus sel di G1 melainkan masuk ke fase S dan terjadi
replikasi DNA dan seterusnya sehingga terjadi proliferasi sel yang dijumpai
pada sel tumor (Stacey et al., 2001).
Daftar pustaka
Adari H,
Lowy DR, Willumsen BM, Der CJ, Mccormick F., 1988. Guanosine Triphosphatase
Activating Protein (GAP) Interacts With The P21 Ras Effector Binding Domain. Science. 240:518.
Barbacid M.
1987. Ras Genes. Ann Rev Biochem. 56:779
Flores, E.R
dan Jacks, T., 2005. P53 Family Members:
P63 And P73 dalam The P53 Tumor Suppressor Pathway And
Cancer, Edited By Zambetti. Springer Science, New York.
Jortner, B.S., dan Percy, D.H., 1978. The nervous system, Neoplasms, dalam Pathology of laboratory Animals, volume I (Benirschke, K., Garner, F.M., dan
Jones, T.C. eds.), Spinger-Verlag, New York Inc. America, pp:379-390.
Kim, Y., Hong, H-H., Lachat, Y., Clayton, N.P.,
Devereux, T.R., Melnick, R.L., Hegi, M.E., dan Sills, R.C., 2005. Genetic
alteration in brain tumors following 1,3-butadiene exposure in B6C3F1
mice. Toxicol Pathol. 33:307-312.
Kleihues, P., Aguzzi, A., and Ohgaki, H. (1995). Genetic
and environmental factors in the etiology of human brain tumors. Toxicol
Lett 82–83, 601–5.
Leestma,
J.E., 1980. Brain tumors. Am. J. Pathol.
100:240-316.
Levine,
A.J., Bargonetti,J., Bond, G.L., Hoh,
J., Kenan Onel, Michael Overholtzer, Archontoula
Stoffel, Angelica K. Teresky, Christine A. Walsh, And
Shengkan Jin. 2005. The P53 Network
dalam The P53 Tumor Suppressor Pathway And
Cancer, Edited By Zambetti. Springer Science, New York.
Louis, D.N., Ohgaki, H., Wiestler, O.D., et al, 2007.
The 2007 WHO classification of tumors of the central nervous system. Lyon,
France: IARC Press.
Maher, A.A., Furnari, F.B.,
Bachoo, R.M., Rowitch, D.H., Louis, D.N., Cavenee, W.K., dan DePinho, R.A.,
2001. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15:1311-1333
Mccormick. F. 1989. Ras GTPase Activating Protein:
Signal Transmitter And Signal Terminator. Cell,
56: 5-8.
Momand, J.,
Aspuria, P.J., dan Furuta, S., 2005. Mdm2
And Mdmx Regulators of P53 Activity dalam The P53 Tumor Suppressor Pathway And Cancer, Edited By Zambetti. Springer Science, New York.
Stacey M. Ivanchuk, Soma Mondal, Peter
B. Dirks And James T. Rutka, 2001.The INK4A/ARF
Locus: Role In Cell Cycle Control And Apoptosis And Implications For Glioma Growth Journal
Of Neuro-Oncology 51: 219-229.
Sigal, A., dan Rotter, V.,
2005. The Oncogenic Activity Of P53
Mutants dalam The P53 Tumor Suppressor Pathway And
Cancer, Edited By Zambetti. Springer Science, New York.
Yamate, J., Tajima, M.,
Nunoya, T., dan Kudow, S., 1987. Spontaneous tumors of the central nervous
system of fisher 344/DuCrj Rats. Jpn. J.
Vet. Sci. 49(1):67-75.
Wen, P.Y., dan Kesari, S.,
2008. Malignant gliomas in adults. N.
Engl. J. Med. 395:492-507.









Komentar
Posting Komentar