MEKANISME PENURUNAN BERAT BADAN PADA TIKUS AKIBAT PEMBERIAN FLUOKSETIN HCl 10mg/kg
Fluoksetin biasa digunakan sebagai antidepresi yang bekerja
sebagai penghambat ambilan kembali serotonin secara selektif (selective serotonin re-uptake inhibitors,
SSRI) (Departemen Kesehatan RI. Direktorat Jenderal Pengawasan Obat dan
Makanan, 2000). Fluoksetin merupakan salah satu bahan kimia atau obat yang
digunakan dalam penelitian sebagai control anti-stres dan bahan pemicu
proliferasi sel di otak.
Menurut Malberg et al.
(2003) fluoksetin mampu meningkatkan proliferasi sel di hippokampus tikus
dewasa. Pemberian fluoksetin 5 mg/kg BB secara i.p selama 14-28 hari (Malberg et al., 2000; Náměstková et al., 2005) mampu meningkatkan
proliferasi sel atau neurogenesis. Pemberian fluoksetin 10 mg/kg BB
secara p.o selama 21 hari mampu meningkatkan level BDNF (de Foubert et al., 2004) yang berperan dalam menstimulasi proliferasi sel (Lee et al., 2002, Choi
et al., 2009; Zhang et al., 2011).
Menurut D'Souza et
al. (2004) pemberian fluoksetin pada tikus dapat menyebabkan
terjadinya penurunan berat badan. Penurunan berat badan ini diduga berhubungan
dengan terjadinya penurunan nafsu makan (Irawan, 2012).
Sudah diketahui bahwa
control nafsu makan atau appetite
diperankan oleh hypothalamus yaitu pada nucleus
arcuatus hypothalamus (ARC) dan nucleus
paraventricular hypothalamus (PVH). Neuron-neuron pada ARC ini memiliki
reseptor serotonin yang dapat memacu pembebasan ligan lainnya sehingga memberi
sinyal berikutnya pada PVH dan memberi reaksi biologis terhadap nafsu makan.
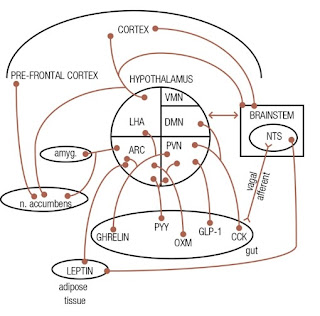
Berikut adalah gambaran regulasi dan control hypothalamus:
Gambar 1. Pathway antara hypothalamus, brainsteam,
area cortical dalam regulasi control nafsu makan (appetite). Adanya projeksi nuclei hypothalamic ke area korteks
pre-frontal akan memberi mempengaruhi
taste aversion dan begitu juga ke amygdala dan nucleus accubens. Adanya aksi
hormon dari usus melalui aksi afferent vagal menuju nuclei di brainsteam akan
memberi sinyal pada hypothalamus untuk mempengaruhi nafsu makan. Beberapa
hormon usus juga dapat bekerja secara langsung ke nucleui di hypothalamic yaitu
melalui sirkulasi maupun menyeberangi blood
brain barrier yang incomplete. Leptin yang dibebaskan juga dapat bekerja
langsung pada nuclui di brainsteam seperti halnya pada nucleus hypothalamus sehingga
modulasi appetite dapat dilakukan
dengan berbagai cara (Simpson et al.,
2009).
Mekanisme penurunan berat badan
pada tikus akibat pemberian fluoksetin HCl 10mg/kg
Pemberian fluoksetin pada
tikus dapat menyebabkan terjadinya penurunan berat badan (D'Souza et
al., 2004) dan diduga penurunan berat badan ini berhubungan dengan
terjadinya penurunan nafsu makan (Irawan, 2012). Pemberian fluoksetin diketahui
mampu meningkatkan kadar serotonin (Zhou
et al., 2009). Bila serotonin berikatan dengan reseptor 5-HT2C
pada neuron pro-opiomelanocortin (POMC) di nucleus arcuatus hypothalamus (ARC)
akan menyebabkan sintesis dan pembebasan α-melanocyte-stimulating
hormone (α-MSH). Ligan α-MSH akan berikatan dengan reseptor melanocortin 4 (MC4R)
di nucleus paraventricular hypothalamus (PVH) yang berperan dalam mengatur
keseimbangan energi, homeostatis glukosa serta memberi respon berupa penurunan
nafsu makan. Penurunan nafsu makan akibat aktivitas MC4R selanjutnya memberi
dampak berupa penurunan berat badan (Benoit et
al., 2000; Lam et al., 2008;
Simpson et al., 2009; Garfield dan
Heisler, 2009; Tao, 2010; Xu et al.,
2010; Feijó et al., 2011; Rossi et al., 2011) sehingga adanya pemberian
fluoksetin pada tikus akan memacu penurunan nafsu makan yang berdampak pada
penurunan berat badan.
Gambar 2. Peningkatan
bioavailability serotonin 5HT (dari food
intake atau komponen farmakologi) akan bekerja secara langsung terhadap reseptor
5-HT2C (5HT2CR) dan reseptor 5HT1B (5HT1BRs). Reseptor ini akan
memodulasi pro-opiomelanocortin
(POMC)/cocaine dan amphetamine regulated transcript (CART) serta
neurons agouti related protein
(AgRP)/neuropeptide Y (NPY) pada nucleus
arcuate hypothalamus (ARC). Reseptor 5-HT2C (5HT2CR) ini terdapat
pada neuron anorectic POMC dan apabila reseptor ini diaktivasi melalui ikatan
serotonin (5HT) dengan reseptornya (5-HT2C) maka akan terjadi
pembebasan α-melanocyte-stimulating hormone (α-MSH). MSH akan berikatan dengan
reseptornya yaitu melanocortin 4 receptor (MC4R) yang terdapat pada nucleus paraventricular
hypothalamus (PVH) sehingga memberi sinyal biologis untuk terjadinya anoreksia.
Sedangkan aktivasi reseptor serotonin 5HT1B (5HT1BRs) pada neuron orexigenic
AgRP/NPY di ARC menyebabkan terjadinya hyperpolarisasi membrane sehingga
menghambat pembebasan neuropeptide. Selanjutnya pengurangan sinyal neuroendocrine
akan mempromosikan rasa kenyang (satiety) dan penghentian food intake (Garfield
dan Heisler, 2009)
Daftar pustaka
Benoit, S.C.,
Schwartz, M.W., Lachey, J.L., Hagan, M.M., Rushing, P.A., Blake, K.A.,
Yagaloff, K.A., Kuryiko, G., Franco, L., Danhoo, W., dan Seeley, R.J., 2000. A
novel selective melanocortin-4 receptor agonist reduces food intake in rats and
mice without producing aversive consequences. The Journal of Neuroscience, 20(9):3442-3448.
Choi, S.H., Li,
Y., Parada, L.F., dan Sisodia, S.S., 2009. Regulation of hippocampal progenitor
cell survival, proliferation and dendritic development by BDNF. Molecular Neurodegeneration, 4:52.
de Foubert, G.,
Carney, S.L., Robinson, C.S., Destexhe, E.J., Tomlinson, R., Hicks, C.A.,
Murray, T.K., Gaillard, J.P., Deville, C., Xhenseval, V., Thomas, C.E.,
O’Neill, M.J.O., dan Zetterström, T.S.C., 2004. Fluoxetine-induced change in
rat brain expression of brain-derived neurotrophic factor varies depending on
length of treatment. Neuroscience,
128(3):597-604.
Departemen
Kesehatan RI. Direktorat Jenderal Pengawasan Obat dan Makanan, 2000.
Informatorium Obat Nasional Indonesia 2000. CV Sagung Seto, Jakarta. hlm. 145.
D’Souza, D.N.,
Zhang, Y., Garcia, F., Battaglia, G., dan Van de Kar, L.D., 2004.
Fluoxetine-induced changes in body weight and 5-HT1A
receptor-mediated hormone secreation in rats on a tryptophan-deficient diet. American Journal of Physiology – Regulatory,
Integrative, and Comparative Physiology, 286:R390-397.
Feijó, F. D.M.,
Bertoluci, M.C., dan Reis, B., 2011. Serotonin and hypothalamic control of
hunger: a review. Revista da Associação
Médica Brasileira, 57(1):74-77.
Garfield, A.S.,
dan Heisler, L.K., 2009. Pharmacological targeting of the serotonergic system
for the treatment of obesity. The Journal
of Physiology, 587(1):49-60.
Lam, D.D.,
Przydzial, M.J., Ridley, S.H., Yeo, G.S.H., Rochford, J.J., O’Rahilly, S., dan
Heisler, L.K., 2008. Serotonin 5-HT2C receptor agonist promotes
hypophagia via downstream activation of melanocortin 4 receptors. Endocrinology, 149(3):1323-1328.
Lee, J., Duan,
W., dan Mattson, M.P., 2002. Evidence that brain-derived neurotrophic factor is
required for basal neurogenesis and mediates, in part, the enhancement of neurogenesis
by dietary restriction in the hippocampus of adult mice. Journal of Neurochemistry, 82:1367-1375.
Malberg, J.E.,
Eisch, A.J., Nestler, E.J., dan Duman, R.S., 2000. Chronic antidepressant
treatment increases neurogenesis in adult rat hippocampus. The Journal of Neuroscience, 20(24):9104-9110.
Malberg, J.E.,
dan Duman, R.S., 2003. Cell proliferation in adult hippocampus is decreased by
inescapable stress: reversal by fluoxetin treatment. Neuropsychopharmacology, 28:1562-1571.
Náměstková, K.,
Šimonová, Z., dan Syková, E., 2005. Decreased proliferation in the adult rat
hippocampus after exposure to the Morris water maze and its reversal by
fluoxetine. Behavioural Brain Research,
163:26-32.
Rossi, J.,
Balthasar, N., Olson, D., Scott, M., Berglund, E., Lee, C.E., Choi, M.J.,
Lauzon, D., Lowell, B.B., dan Elmquist, J.K., 2011. Melanocortin-4 receptors
expressed by cholinergic neurons regulate energy balance and glucose
homeostasis. Cell Metabolism,
13:195-204.
Simpson, K.A.,
Martin, N.M., dan Bloom, S.R., 2009. Hypothalamic regulation of food intake and
clinical therapeutic applications. Arquivos
Brasileiros de Endocrinologia and Metabologia, 53(2):120-128.
Xu, Y., Jones,
J.E., Lauzon, D.A., Anderson, J.G., Balthasar, N., Heisler, L.K., Zinn, A.R.,
Lowell, B.B., dan Elmquist, J.K., 2010. A serotonin and melanocortin circuit
mediates D-Fenfluramine
anorexia. The Journal of Neuroscience,
30(44):14630-14634.
Zhang, Q., Liu,
G., Wu, Y., Sha, H., Zhang, P., dan Jia, J., 2011. BDNF promote EGF-induced
proliferation and migration of human fetal neural stem/progenitor cells via the
PI3K/akt pathway. Molecules,
16:10146-10156.
Zhou, Z., Zhen,
J., Karpowich, N.K., Law, C.J., Reith, M.E.A., dan Wang, D-N., 2009.
Antidepressant specificity of serotonin transporter suggested by three
LeuT-SSRI structures. Nature Structural
and Molecular Biology, 16(6):652-657.




Komentar
Posting Komentar