IHC PART 1: ANTIBODY & ANTIGEN, FIKSASI, ANTIGEN RETRIEVAL (AR), ENDOGENOUS BIOTIN, ENDOGENOUS PEROXIDASE
Imunohistokimia
(IHC) merupakan suatu teknik yang banyak digunakan pada laboratorium veteriner
maupun bidang biomedis untuk kepentingan diagnose maupun penelitian. Berikut
adalah prosedur standar yang biasa digunakan dalam melakukan IHC (dengan metode
avidin biotin complex / ABC method):
Tabel
1. Prosedural standar metode ABC dalam teknik IHC (Ramos-Vara, 2005)
Untuk
mempelajari tentang teknik IHC ini kita perlu mengenal lebih lanjut aspek-aspek
yang mempengaruhi keberhasilan seperti ikatan antibody dan antigen serta faktor-faktor
yang menghalang ikatan tersebut dan faktor-faktor yang menghalang munculnya
warna pada jaringan yang diwarnai
ANTIBODY DAN ANTIGEN
Antigen
merupakan partikel atau substansi ataupun protein yang ingin kita warnai.
Antigen ini nantinya akan berikatan dengan antibody primer. Antibody primer tersebut
dapat kita dapati dengan memproduksi sendiri atau umumnya dibeli dari produsen
seperti Sigma-Aldrich, Novocastra-Leica biosystems, Thermofisher, Merck Milipore, Santa Cruz Biotechnology Inc, Abcam, Cellsignal, dan lain-lain. Antibody primer yang
digunakan dapat berbentuk monoclonal antibody ataupun polyclonal antibody.
Monoclonal antibody hanya mengenali satu epitope spesifik, sedangkan polyclonal
antibody mengenali multiple epitope (epitope adalah bagian pengenalan pada
antigen, sedangkan bagian antibody yang mengenali epitope dikenal sebagai
paratope).
Gambar
1. Bagian-bagian antibody (Chemicon
International, Inc)
Gambar
2. Polyclonal dan monoclonal antibody (Chemicon International, Inc)
Tabel
2. Perbedaan polyclonal antibody dan monoclonal antibody (Ramos-Vara, 2005)
Pada
teknik IHC, antigen di jaringan mungkin dapat tidak terikat dengan antibody
yang kita berikan (antibody diberikan secara ditetesi pada jaringan di slide).
Hal ini dikarenakan adanya faktor-faktor yang menghalang pengenalan antibodi
terhadap antigen. Adanya kesalahan pemilihan antibody dapat menjadi salah satu
penyebab IHC tidak berhasil. Apabila membeli antibody kita harus perhatikan
maklumat yang terdapat pada data sheet
antibody. Maklumat yang perlu diperhatikan dari data sheet antibody primer
tersebut antara lain: species reactivity, tested application dan dilution,
detail antibody (monoclonal / polyclonal, host: mouse atau rabbit), storage
buffer dan storage condition (refrigerator 4 ⁰C atau freezer) serta informasi umum dan
metode serta gambaran hasil pewarnaan yang dilampirkan pada data sheet. Berikut
adalah contoh data sheet dari Thermofisher untuk antibody primer mouse
monoclonal MAP-2 (AP18):
Pemilihan
antibody primer sangat berpengaruh terhadap pemilihan antibody sekunder.
Apabila antibody primer dalam bentuk mouse monoconal maka antibody sekunder
haruslah anti-mouse. Begitu juga bila antibody primer kita adalah rabbit
polyclonal maka antibody sekunder kita haruslah anti-rabbit.
Pada
proses perlakuan pada jaringan seperti pengawetan / fiksasi dan bloking (dengan
paraffin) juga dapat menutupi epitope bahkan merusak epitope antigen sehingga
tidak dapat dikenali oleh antibody. Oleh karena itu, sebelum melakukan IHC kita
harus mengetahui dengan detail apakah antigen pada jaringan yang akan kita
warnai sensitive apabila diberi perlakuan seperti perendaman alcohol, xylene,
dan sebagainya sehingga dapat menyebabkan kerusakan antigen. Dengan begitu kita
dapat memutuskan apakah jaringan yang ingin kita teliti dapat dibloking dengan
paraffin ataupun secara bloking secara frozen. Untuk antigen yang lebih
sensitive terhadap bahan kimia disarankan diblok secara frozen.
Metode
yang pernah dilakukan oleh peneliti lain dapat menjadi bahan pertimbangan dalam
memutuskan metode yang ingin digunakan. Kita juga dapat menggunakan maklumat metode IHC yang tersedia pada data sheet
antibody yang akan dibeli (coba pelajari dari beberapa data sheet yang
disediakan di website Sigma-Aldrich, Novocastra-Leica biosystems, Thermofisher,
Chemicon International, Santa Cruz Biotechnology Inc, dan lain-lain).
PENGARUH FIKSASI TERHADAP ANTIGEN
Fiksasi
jaringan merupakan hal yang penting untuk melindungi atau mengawetkan komponen
seluler termasuk protein soluble maupun protein structural, mencegah autolysis,
dan menstabilkan material seluler terhadap efek perlakuan yang akan diberikan.
Namun fiksasi seperti penggunaan formaldehyde dapat menyebabkan perubahan
konformasi makromolekul antigen sehingga bagian pengenalan antigen tidak dikenali
oleh antibody sehingga menjadi factor penyebab kegagalan IHC. Hal dapat ini
berlaku apabila terjadi ikatan formaldehyde dengan antigen. Untuk memperbaiki
keadaan ini kita dapat meleraikan ikatan tersebut dengan penggunaan antigen retrieval (AR).
Gambar 4. Formaldehyde dan cross-linking fixatives (Ramos-Vara, 2005)
Gambar
5. Reaksi Formaldehyde terhadap protein (D'Amico et al., 2009)
Gambar
6. Fiksasi alcohol. Alkohol akan berinteraksi dengan protein hydrophobic
moieties dan memodifikasi struktur tertiary protein (Ramos-Vara, 2005)
ANTIGEN
RETRIEVAL
Berikut adalah beberapa contoh bahan yang dapat
digunakan sebagai antigen retrieval.
Tabel
3. Teknik antigen retrieval IHC (D'Amico
et
al.,
2009)
Some examples of chemical and physical
approaches used in antigen retrival
|
|
Chemical approach
|
|
Enzymatic digestion
|
Proteinase K, trypsin chymotrypsin,
pronase, pepsin, N-glycanase F, hyaluronidase
|
Denaturant and chaotropic treatment
|
Formic acid,
guanidine hydrochloride, guanidine thiocyanate, urea, boric acid, acetic
acid, SkipDewaxTM, sodium dodecyl sulfate, citraconic acid
|
Bleaching (oxidizing treatment)
|
Periodic acid, hydrogen peroxide,
sodium meta periodate
|
Etching
|
Sodium (potassium)
hydroxide in (m)ethanol
|
Detergent treatment
|
Triton X-100
|
Physical approach
|
|
Heat treatment
|
Source: microwave,
autoclave, pressure cooker, steamer, water bath; In solution of: distilled
water, sucrose, EDTA, EGTA, TBS, aluminum chloride, zinc sulfate, lead
thiocyanate, citrate buffer, borate
|
Ultrasound treatment
|
|
Such a schematic subdivision is not rigorous, because many approaches
result by the combination of two or more treatment. For example, most
chemical treatments are performed by heat. Furthermore, some substances can
show different chemical effects.
|
|
Metode
antigen retrieval yang sering digunakan dalam IHC adalah enzimatik dan juga
heat-induced epitope retrieval (HIER) (Ramos-Vara, 2005).
HIER memiliki efek yang baik untuk membantu membuka mask pada epitope (dalam hal mendeteksian antigen) pada preparat
yang difiksasi dengan formaldehyde (cross-linking fixative). Larutan yang
sering digunakan dalam proses HIER seperti TBS dan citrate buffer. Biasanya
slide preparat direndam larutan tersebut dan dipanaskan dengna suhu dan waktu
tertentu baik dengan cara di microwave, boiling, steamer, waterbath, incubator
dan sebagainya.
Gambar 7. Gambaran HIER: Heat induced epitope retrieval
(Ramos-Vara,
2005)
Namun penggunaan HIER memiliki kelemahan yaitu dapat meningkatkan
ekspresi endogenous biotin pada sel-sel tertentu pada organ tertentu yang
mengandung banyak mitokondria seperti sel hepar, ginjal, glandula mamae,
jaringan adiposa dan lien, sehingga menimbulkan efek positif palsu. Namun
kelemahan ini hanya muncul pada prosedur tertentu yang dipengaruhi lama dan
tingkat suhu yang digunakan pada organ tertentu. Jadi tidak semua organ yang
diwarnai IHC dengan prosedur HIER akan menyebabkan timbulnya positif palsu.
ENDOGENOUS BIOTIN
Positif palsu dapat terjadi akibat endogenous biotin pada jaringan
berikatan dengan avidin-biotin peroksidase yang diberikan (ABC). Ikatan endogenous
biotin-avidin-biotin-peroksidase selanjutnya bereaksi terhadap kromogen DAB+H2O2
diberikan. Reaksi pada DAB akan menyebabkan sel yang mengandung biotin
endogenous berwarna coklat keemasan. Sel yang memiliki biotin endogenous ini
mungkin tidak mengandung antigen yang ingin kita warnai karena reaksi ABC-DAB dapat
terjadi tanpa ikatan antigen dan antibody (langsung berikatan dengan biotin
endogenous).
Gambar
8. Gambaran ikatan antigen-antibody - avidin biotin peroxidase + kromogen dibandingkan
dengan ikatan biotin endogenous - avidin biotin peroxidase + kromogen.
Positif palsu dapat dikonfirmasi dengan penggunaan kontrol
negative (slide yang diwarnai tanpa antibody primer). Hasil pewarnaan pada
kontrol negative yaitu seharusnya tidak adanya warna coklat keemasan pada
jaringan (bila menggunaan kromogen DAB yang mengikat avidin biotin kompleks).
Bila terjadi peningkatan ekpresi endogenous biotin pada pada control negative juga
akan muncul warna coklat keemasan. Bila hal ini terjadi kita perlu melakukan
blok endogenous biotin atau mencoba metode lain tanpa penggunaan Avidin-biotin
peroksidase.
Gambar
9. Gambaran reaksi antigen-tanpa antibodi primer + avidin biotin peroxidase + kromogen dibandingkan
dengan ikatan biotin endogenous-avidin biotin peroxidase + kromogen.
Blok endogenous biotin dapat dilakukan dengan memberikan avidin
dalam jumlah berlebih pada sampel, dengan harapan endogenous biotin dapat
diikat oleh avidin. Selanjutnya avidin diikat dengan biotin bebas (biotin yang
tidak terikat dengan peroksidase). Hal ini akan mengakibatkan endogenous biotin
tidak dapat berikatan dengan avidin-biotin peroksidase yang kita berikan, sehingga
DAB yang diberikan tidak akan berikatan dan tidak akan bereaksi terhadap endogenous
biotin.
Gambar
10. Gambaran reaksi ikatan biotin endogenous-avidin biotin peroxidase + kromogen
dibandingkan dengan ikatan biotin endogenous yang diblok dengan avidin bebas
dan biotin bebas.
Sumber avidin bebas seperti putih telur dan sumber biotin bebas seperti
skim milk. Untuk memblok endogenous biotin juga dapat menggunakan produk dari produsen
antibody seperti dari produk Thermofisher yaitu avidin (Streptavidin
atau protein biotin-binding lainnya yaitu Streptavidin (Product No. 21122,
21125), NeutrAvidin Protein (Product No. 31000) atau Avidin (Product No. 21121,
21128) untuk mengikat endogenous biotin. Selanjutya avidin yang telah berikatan
dengan endogenous biotin diikat lagi dengan pemberian Biotin seperti D-Biotin
(Product No. 29129).
ENDOGENOUS
PEROXIDASE
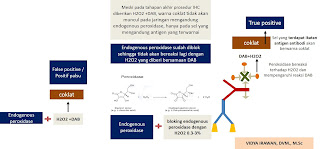
Positif
palsu juga dapat terjadi akibat adanya endogenous peroxidase dimana peroxidase pada
jaringan ini dapat bereaksi dengan H2O2 yang diberikan
bersama DAB sehingga menimbulkan warna coklat pada sel yang mengandung
endogenous perosidase. Endogenous peroxidase banyak terdapat pada hemoproteins seperti
hemoglobin (sel darah merah), myoglobin (sel otot), cytochrome (granulocytes,
monocytes) dan catalases (liver and kidney). Untuk mencegah terjadinya positif
palsu pada tahapan awal pewarnaan IHC kita lakukan blok endogenous peroxidase
dengan pemberian H2O2. Konsentrasi H2O2 yang
diberikan sekitar 0.3 – 3%. Pengencer H2O2 yang sering
digunakan adalah distilled water atau aquabidest dan methanol. Penggunaan
distilled water lebih murah dan biasanya konsentrasi H2O2 yang
digunakan adalah 3% dimana slide biasanya direndam dalam jar berisi larutan ini
selam 15-30 menit pada suhu ruang. SEdangkan penggunaan methanol lebih mahal
dan konsentrasi H2O2 yang digunakan adalah 0.3% dengan cara meneteskan larutan
tersebut diatas permukaan jaringan pada slide dan disarankan ditutup dengan
parafilm agar tidak cepat menguap. Biasanya jaringan dibiarkan selama 5-10
menit pada suhu ruang.
Daftar Pustaka
Chemicon International, Inc.,
Introduction to antibodies
2nd edition
D'Amico .F., Evangelia Skarmoutsou, Franca Stivala,
2009. State of the art in antigen retrieval for immunohistochemistry. Journal
of Immunological Methods, 341:1–18
Ramos-Vara,
J.A., 2005. Technical Aspects of Immunohistochemistry. Vet. Pathol., 42:405–426
Thermo
fisher scientific, MAP-2 AP18 datasheet. Thermoscientific.com/pierce
Worthington
Biochemical Corporation 2015 http://www.worthingtonbiochem.com:8080/resources/images/enzyme-manual/HPO/reaction.jpg