MEKANISME ADAPTASI TERHADAP STRES SELAMA PERLAKUAN KRONIK RESTRAIN STRES PADA TIKUS
Pendahuluan
Stres merupakan reaksi biologis terhadap rangsangan yang mengganggu homeostatis tubuh baik faktor fisik maupun psikis. Respon stres yang terjadi akan memicu tubuh untuk menghadapi kondisi lingkungan yang berubah, namun bila stimulus yang memicu stres berlangsung lama atau besarnya melebihi kemampuan adaptasi akan menyebabkan gangguan pada sistem saraf dan hormonal. Stres secara kronis pada hewan merupakan salah satu permasalahan kesehatan yang menyebabkan penurunan status kesehatan, reproduksi serta kemampuan learning yang dibutuhkan dalam proses adaptasi agar dapat bertahan di lingkungan atau habitatnya.
Guna mempelajari mekanisme stress kronis maupun pengujian obat anti stress, hewan percobaan seperti tikus akan dikondisikan dalam keadaan stress. Salah satu metode yang digunakan untuk membuat tikus menjadi stress secara kronis adalah dengan perlakuan restraint stress. Restrain stress dilakukan dengan memasukkan tikus ke dalam pipa restrainer durasi 6 jam per hari selama 21 hari. Selama perlakuan stres, restrainer berisi tikus ditempatkan di dalam kandang pemeliharaan sedangkan tikus pada kontrol non stres dibiarkan bebas di dalam kandangnya (Xu et al., 2009).
Video metode restrain stress pada tikus.
Namun dalam melakukan restrain stress pada tikus dalam jangka waktu yang lama (sekitar 10-21 hari) diduga dapat terjadinya kompensasi tubuh dalam menghadapi stress yaitu berupa adaptasi terhadap stress. Dalam menetukan terjadi atau tidaknya adaptasi terhadap stress ini peneliti perlu melakukan konfirmasi dengan menganalisa konsentrasi kortikosteron per hari selama perlakuan stres. Harris et al. (2002) dan Mizoguchi et al. (2003) melaporkan terjadinya adaptasi terhadap stres sejak hari ke-10 perlakuan restraint stress.
Mekanisme adaptasi terhadap stress
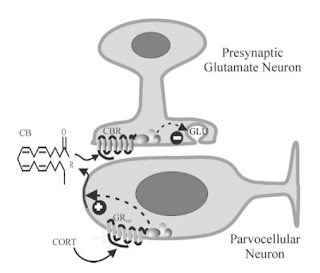
Adaptasi terhadap stres selama restraint stress dapat terjadi akibat paparan kortikosteron secara terus menerus yang akan meningkatkan sensitifitas reseptor cannobinoid CB1 (Rademacher et al., 2008). Reseptor ini akan berikatan dengan ligan endocannobinoid 2AG (2-arachidonylglycerol) yang distimulasi oleh mekanisme umpan balik negatif reseptor glukokorticoid (Di et al., 2003). Aktivitas 2AG/CB1 akan memodulasi sinyal pada presinapsis glutamatergik untuk menghambat pembebasan glutamat (Patel et al., 2004; Patel dan Hillard, 2008; Evanson et al., 2010) sedangkan glutamat berperan penting untuk terjadinya sekresi corticotrophin-releasing factor (CRF) dari paraventricular nucleus (PVN) hypothalamus. Penghambatan pembebasan glutamat akan menyebabkan penurunan respon hypothalamus pituitary adrenal axis HPA (penurunan sekresi CRF) sehingga menurunkan sekresi kortikosteron (Pinnock dan Herbert, 2001; Fernandes et al., 2002; Di et al., 2003; Kamprath et al., 2009; Hill et al., 2010; Hill dan Tasker, 2012). Penurunan kortikosteron pada tikus selama perlakuan stres menandakan tikus mengalami adaptasi atau habituasi terhadap stres (Ma dan Lightman, 1998; Pinnock dan Herbert, 2001; Fernandes et al., 2002; Patel et al., 2004; Girotti et al., 2006; Leussis dan Bolivar, 2006).
Gambar 1. Gambaran aksi glukokorticoid pada neuron parvocelluler paraventricular nucleus (PVN). Glucocorticoid (CORT) akan berikatan dengan G-protein-coupled glucocorticoid receptor GRmb) dan mengaktifkan intracellular signaling pathway yang menyebabkan sintesis endocannabinoid (CB). CB akan berikatan dari neuron PVN akan berikatan dengan reseptor G-protein-coupled CB1 cannabinoid (CBR) pada terminal presinaptik glutamate mengaktifkan sinyal secara cascade sehingga menghambat pembebasan glutamate (GLU) ke neuron PVN dan menyebabkan penurunan aktivitas neuronal PVN dan sekresi hormonal (Di et al., 2003).
Daftar Pustaka
Di, S., Malcher-Lopes, R., Halmos, K.Cs., dan Tasker, J.G., 2003. Nongenomic glucocorticoid inhibition via endocannabinoid release in the hypothalamus: a fast feedback mechanism. The Journal of Neuroscience, 23(12):4850-4857.
Evanson, N.K., Tasker, J.G., Hill, M.N., Hillard, C.J., dan Herman, J.P., 2010. Fast feedback inhibition of the HPA axis by glucocorticoids is mediated by endocannabinoid signaling. Endocrinology, 151(10):4811-4819.
Fernandes, G.A., Perks, P., Cox, N.K.M., Lightman, S.L., Ingram, C.D., dan Shanks, N., 2002. Habituation and cross-sensitization of stress-induced hypothalamic-pituitary-adrenal activity: effect of lesions in the paraventricular nucleus of the thalamus or bed nucleui of the stria terminalis. Journal of Neuroendrocrinology, 14:593-602.
Girotti, M., Pace, T.W.W., Gaylord, R.I., Rubin, B.A., Herman, J.P., dan Spencer, R.L., 2006. Habituation to repeated restraint stress is associated with lack of stress-induced c-fos expression in primary sensory processing areas of the rat brain. Neuroscience, 136:1067-1081.
Harris, R.B.S., Mitchell, T.D., Simpson, J., Redmann, S.M., Youngblood, Jr. B.D., dan Ryan, D.H., 2002. Weight loss in rats exposed to repeated acute restraint stress is independent of energy or leptin status. American Journal of Physiology – Regulatory, Integrative, and Comparative Physiology, 282:R77-R88.
Hill, M.N., McLaughlin, R.J., Bingham, B., Shrestha, L., Lee, T.T.Y., Gray, J.M., Hillard, C.J., Gorzalka, B.B., dan Viau, V., 2010. Endogenous cannabinoid signaling is essential for stress adaptation. Proceedings of The national Academy of Sciences, 107(20):9406-9411.
Hill, M.N., dan Tasker, J.G., 2012. Endocannabinoid signaling, glucocorticoid-mediated negative feedback, and regulation of the hypothalamic-pituitary-adrenal axis. Neuroscience, 204:5-16.
Kamprath, K., Plendi, W., Marsicano, G., Deussing, J.M., Wurst, W., Lutz, B., dan Wotjak, C.T., 2009. Endocannabinoids mediate acute fear adaptation via glutamatergic neurons independently of corticotropin-releasing hormone signaling. Genes, Brain and Behavior, 8:203-211.
Leussis, M.P., dan Bolivar, V.J., 2006. Habituatuion in rodents: a review of behavior, neurobiology, and genetics. Neuroscience and Biobehavioral Reviews, 30:1045-1064.
Mizoguchi, K., Ishige, A., Aburada, M., Tabira, T., 2003. Chronic stress attenuates glucocorticoid negative feedback: involvement of the prefrontal cortex and hippocampus. Neuroscience, 119:887-897.
Patel, S., Roelke, C.T., Rademacher, D.J., Cullinan, W.E., dan Hillard, C.J., 2004. Endocannabinoid signaling negatively modulates stress-induced activation of the hypothalamic-pituitary-adrenal axis. Endocrinology, 145(12):5431-5438.
Patel, S., dan Hillard, C.J., 2008. Adaptations in Endocannabinoid signaling in response to repeated homotypic stress: a novel mechanism for stress habituation. European Journal of Neuroscience, 27(11):2821-2829.
Pinnock, S.B., dan Herbert, J., 2001. Corticosterone differentially modulates expression of corticotropin releasing factor and arginine vasopressin mRNA in the hypothalamic paraventricular nucleus following either acute or repeated restraint stress. European Journal of Neuroscience, 13(3):576-584.
Rademacher, D.J., Meier, S.E., Shi, L., Ho, W-S. V., Jarrahian, A., dan Hillard, C.J., 2008. Effects of acute and repeated restraint stress on endocannabioid content in the amygdale, ventral striatum, and medial prefrontal cortex in mice. Neuropharmacology, 54:108-116.
Xu, Y, Lin, D., Li, G., Shyamala, S.G., Barish, P.A., Vernon, M.M., Pan, J., dan Ogle, W.O., 2009. Curcumin reverses impaired cognition and neuronal plasticity induced by chronic stress. Neuropharmacology, 57:463-471.
Xu, Y, Lin, D., Li, G., Shyamala, S.G., Barish, P.A., Vernon, M.M., Pan, J., dan Ogle, W.O., 2009. Curcumin reverses impaired cognition and neuronal plasticity induced by chronic stress. Neuropharmacology, 57:463-471.