TOKSISITAS PARACETAMOL (ACETAMINOPHEN) DAN TREATMENT: PADA KUCING DAN ANJING
Paracetamol
(acetaminophen) merupakan obat yang sering digunakan pada manusia sebagai analgesic dan antipyretic, namun obat ini bersifat toksik pada kucing (tanpa
adanya dosis aman) serta pada anjing (bila overdosis). Pada artikel ini dibahas
mengenai paracetamol dan metabolismenya, mekanisme toksisitas paracetamol,
diagnose (anamnesa, gejala klinis, perubahan patologi klinis dan anatomi), serta
treatment.
PARACETAMOL
Paracetamol
atau acetaminophen merupakan derivate sintetik nonopiate dari p-aminophenol
(Steenbergen, 2003). Paracetamol merupakan nonsteroidal anti inflamasi yang
sering digunakan sebagai analgesic
(obat penghilang rasa sakit) dan antipyretic
(obat anti demam, untuk menurunkan suhu tubuh) dengan efek anti inflamasi yang
lemah. Obat ini dapat meningkatkan ambang batas rasa sakit (Richardson, 2000)
dengan cara menghambat aktivitas enzim cyclooxygenase
(Botting, 2000) serta menghambat efek pyrogen
dengan cara memblok sintesis prostaglandin (Aronoff et al., 2006).
Paracetamol
bersifat larut dalam air (Rossoff, 1994) dan diabsorbsi secara cepat pada
tractus gastrointestinal (Steenbergen, 2003). Puncak konsentrasi keberadaan
obat di dalam plasma dapat dilihat 1 jam setelah pemberian. Ikatan paracetamol
dengan protein plasma tidak begitu kuat atau lemah yaitu sekitar 5 – 20 %
sehingga obat mudah terdistribusi luas ke seluruh tubuh (Khan, 2014). Hal ini berbeda dengan obat yang memiliki ikatan
kuat terhadap protein plasma dimana ikatan protein yang kuat tersebut dapat bersifat
sebagai reservoir sehingga menyebabkan penurunan distribusi serta keterbatasan
transport molekul membran capillary
(Jerzsele, 2012).
Sebagian
besar paracetamol dimetabolisme di liver dan beberapa dimetabolisme di ginjal
(Steenbergen, 2003). Metabolism
paracetamol melalui 2 fase yaitu fase I dimana obat mengalami oksidasi oleh
cytochrome P450 (CYP450) dan biasanya
menghasilkan metabolit yang bersifat toksik. Metabolit ini kemudian dikonjugasi
pada fase II (Jerzsele, 2012) dimana pada fase ini metabolit tersebut mengalami
penurunan toksisiti sehingga menjadi lebih aman. Metabolit selanjutnya dieliminasi
dan dieksresikan melalui empedu (Steenbergen, 2003).
Pada
kebanyakan spesies hewan, metabolisme paracetamol pada fase II mengalami
konjugasi secara glucuronidation dan
sebagian kecil secara sulfation
(Rossoff, 1994; Jerzsele, 2012). Glucuronidation
adalah proses panambahan glucuronic acid
pada substrat yang dimediasi oleh enzim glucuronyl transferase (Jancova et al.,
2010). Pada kucing terjadi kekurangan enzim glucuronyl transferase dan menyebabkan keterbatasan
kemampuan untuk proses metabolism dengan jalur glucuronidation (Khan, 2012) sehingga pada kucing paracetamol
dimetabolisme secara sulfation
(Rossoff, 1994). Namun kapasitas jalur sulfation
pada kucing juga rendah dibandingkan dengan hewan lain (Arondon dan Drobatz,
2000).
Saat kemampuan jalur sulfation mencapai batasnya, paracetamol
akan terus berada di dalam darah sehingga ia lebih banyak dimetabolisme oleh cytochrome
P450 (CYP450) kemudian menjadi metabolit yang dikenal
sebagai N-acetyl-para-benzoquinoneimine
(NAPQI) yang bersifat reaktif dan toxic (Allen, 2003). NAPQI secara normal
didetoksifikasi melalui konjugasi glutation (antioxidant)
namun pemberian paracetamol (overdosis) dapat menyebabkan penurunan level glutation sehingga kurangnya level antioxidant dan terjadi kerusakan
seluler (Nash et al., 1984; Court,
2013).
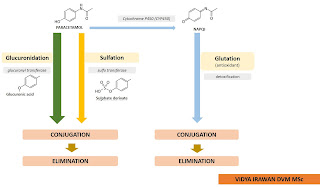
Gambar
1. Skema metabolism paracetamol hewan (kecuali kucing). Sebagian besar dari
metabolit paracetamol akan dikonjugasi secara glucuronidation dan sebagian kecil secara sulfation. Proses konjugasi menyebabkan metabolit menjadi lebih
aman dan mampu dieliminasi. Metabolit yang terbentuk dari reaksi enzim CYP450
seperti NAPQI hanya dalam jumlah yang sedikit dan dapat didetoksifikasi oleh
konjugasi glutation sebagai
antioxidant alami sehingga mampu dieliminasi.
TOKSISITAS PARACETAMOL PADA KUCING
DAN ANJING
Kucing
lebih sensistive dibanding anjing terhadap toksisitas paracetamol. Toksisitas
paracetamol pada kucing disebabkan kucing kekurangan enzim glucuronyl
transferase yang
menyebabkan penurunan kemampuan glucuronidation
sehingga
paracetamol lebih dimetabolisme dengan jalur cytochrome P450 (Allen,
2003; Khan, 2014) dan menyebabkan terjadi akumulasi NAPQI (Jerzsele, 2012).
NAPQI
yang tidak dapat didetoksifikasi akibat level glutation yang ikut menurun (setelah pemberian paracetamol) (Court,
2013) membentuk protein yang bersifat toksik dan berperan sebagai radikal bebas
(Christ dan Brückner, 2012). NAPQI akan merusak hemoglobin, eritrosit, sel-sel
ginjal dan sel-se liver (hepatocyte) (Christ
dan Brückner, 2012; Khan, 2014). NAPQI
akan mengikat protein dan membrane sehingga
mengganggu fungsi protein dan merusak lapisan lipid membrane sel. Hal ini menyebabkan
kelukaan dan kematian sel terutama hepatocyte (Richardson, 2000).
Gambar
2. Skema metabolism paracetamol pada kucing (atau anjing yang mengalami
overdosis). Pada kucing, paracetamol tidak dapat dikonjugasi secara glucuronidation karena kurangnya level
enzim glucuronyl transferase sehingga
metabolit akan dikonjugasi secara sulfation.
Namun pada kucing kemampuan sulfation
juga terbatas sehingga sebagian besat dimetabolisme oleh enzim CYP 450. Metabolit yang terbentuk dari reaksi enzim
CYP450 seperti NAPQI akan terakumulasi. Paracetamol juga dapat menurunkan level
glutation sehingga proses
detoxification terhambat. Akumulasi NAPQI yang bersifat toxic / radikal bebas
akan merusak seluler sehingga menyebabkan kematian sel.
NAPQI
juga menyebabkan oxidative stress
pada eritrosit. Bagian dari eritrosit yang sangat terpengaruh oleh reaksi
oksidatif yaitu pada bagian ion besi dari heme (hemoglobin) dan grup sulfhydryl pada rantai globulin (Allen,
2003). Kelukaan oksidatif pada eritrosit akibat toksisiti paracetamol ini
menyebabkan terbentuknya methemoglobin, anemia Heinz body serta hemolysis
(Engelking, 2010; Salem et al., 2010).
Tidak
ada dosis yang aman pada pemberian paracetamol pada kucing (Steenbergen, 2003).
Dosis 10 mg/kg pada kucing sudah memperlihatkan gejala toksisiti (Osweiler,
1997) sedangkan pada dosis lebih dari 30-40 mg/kg dapat menyebabkan peningkatan
methemoglobin (Cote, 2014). Pada anjing dosis 10 mg/kg BID digunakan dosis
theraupeutic untuk analgesia (Fisher, 1997; Perry, 1998). Gejala toksisiti pada
anjing baru terlihat bila dosis 75-100 mg/kg dan diduga mampu menyebabkan
hepatotoxicity (Fisher, 1997; Cote, 2014) sedangkan pada dosis 200 mg/kg dapat
menyebabkan methemoglobinemia (Fisher, 1997). Gejala toksisiti dapat terlihat dengan
sekali pemberian dosis maupun akibat pemberian dosis yang lebih rendah secara
berulang-ulang (Richardson, 2000; Khan,
2014).
DIAGNOSA
Diagnosa
dapat dilakukan berdasarkan data yang didapat dari anamnesa, gejala klinis,
serta perubahan patologi baik patologi klinis maupun anatomi.
Anamnesa
Riwayat
obat yang dimakan atau kemungkinan termakan, seperti sengaja diberi paracetamol
oleh pemilik atau kemungkinan termakan sediaan paracetamol dengan sediaan dosis
manusia akibat kelalaian pemilik.
Gejala Klinis
Terdapat
beberapa gejala klinis yang dapat diamati akibat toksisitas paracetamol pada
kucing dan anjing sebagai berikut:
Hewan
menjadi lemah, depresi, lethargy, salivasi, hypothermia
(Salem et al., 2010; Siroka dan
Svobodova, 2013; Corrie, 2014; Cote, 2014). Suhu tubuh hewan dapat menjadi
hypothermia namun ini bukanlah hal yang mutlak tergantung pada tingkat
keparahan kondisi hewan dan jangka waktu hewan mengalami toksisitas. Sehingga
suhu tubuh kucing atau anjing yang terpapar paracetamol bisa saja normal,
subnormal, sedikit meningkat ataupun menurun.
Membran
mukosa menjadi pucat, cyanotic atau berwarna gelap
(Salem et al., 2010; Siroka dan
Svobodova, 2013; Corrie, 2014; Cote, 2014). Membran mukosa yang memucat terjadi
akibat anemia. Anemia terjadi karena kerusakan eritrosit yang diinduksi oleh
metabolit NAPQI. NAPQI menyebabkan terjadinya methemoglobin sehingga terjadi
kekurangn oksigen dan menyebabkan membrane mengalami cyanotic. Methemoglobin
juga merubah warna darah menjadi kecoklatan sehingga menyebabkan membrane
mukosa menjadi lebih gelap (Cotter, 2001).
Dyspnea
(sulit bernafas), tachypnea, tachycardia (Salem et al., 2010; Siroka dan Svobodova,
2013; Corrie, 2014; Cote, 2014). Kekurangan oksigen akibat terbentuknya
methemoglobin serta terjadinya hemolytic anemia menyebabkan hewan sulit
bernafas sehingga terjadi peningkatan respirasi untuk memenuhi kebutuhan
oksigen (tachypnea) serta peningkatan
fungsi jantung untuk memompa darah guna memenuhi kebutuhan oksigen (tachycardia). Hal ini dapat dilihat dari
pada pemeriksaan fisik berupa peningkatan respirasi serta pulsus (pulse rate). Hal ini juga bukan mutlak
terjadi tergantung pada tingkat keparahan kondisi hewan dan jangka waktu hewan
mengalami toksisitas sehingga hewan bisa saja mengalami penurunan detak jantung.
Palpasi abdomen anterior mengalami
rasa sakit yang berhubungan dengan hepatomegaly serta adanya icterus
(Salem et al., 2010; Siroka dan
Svobodova, 2013). Hapatomegaly dapat
terjadi akibat adanya gangguan pada liver. Adanya oksidatif oleh NAPQI pada
hepatocyte menyebabkan gangguan fungsi hepar serta kerusakan hepatocyte (Richardson, 2000). Hepar berperan dalam
metabolime tubuh seperti mengatur konjugasi bilirubin agar bisa diekresikan
melalui empedu (Center, 2015). Kerusakan eritrosit oleh oksidatif NAPQI
menyebabkan terjadinya hemolysis (Salem et
al., 2010) sehingga terjadi peningkatan biliribun (produk dari pemecahan
hemoglobin). Peningkatan bilirubin serta berkurangnya fungsi liver menyebabkan
jumlah bilirubin meningkat di darah sehingga terjadinya ichterus (Center,
2015).
Anorexia,
nausea,
muntah
(Salem et al., 2010; Corrie, 2014;
Siroka dan Svobodova, 2013). Hilangnya nafsu makan (anorexia), mual (nusea)
serta muntah merupakan gejala klinis yang dapat terjadi bila hewan mengalami
ketidaknyamanan atau rasa sakit pada daerah abdominal seperti gangguan liver
serta hepatomegaly. Hal ini juga menjadi factor penyebab penurunan berat badan
pada hewan yang sakit.
Edema
pada wajah dan telapak kaki (Corrie, 2014; Cote,
2014). Edema terjadi pada daerah subcutan wajah hingga ke conjungtiva serta
pada telapak kaki. Edema terjadi bila adanya akumulasi cairan yang berlebihan
di dalam jaringan yng terdistribusi di ruang interstitial (Scallan et al., 2010). Edema pada kasus toksisitas
paracetamol diduga sebagai efek lanjutan dari gangguan cardiac secara akut
akibat terjadinya hypoxia (Corrie, 2014; Cote, 2014). Gangguan kerja liver,
jantung dan pulmo dapat meningkatkan permeabilitas vascular (Cho dan Atwood,
2002; Weis, 2008). Terjadinya peningkatan permeabilitas capillary akan
meningkatkan tekanan oncotic interstitial dan menurunkan tekanan oncotic plasma
(pada kasus liver failure) serta
menurunkan tekanan hydrostatic capillary dan meningkatkan tekanan hydrostatic
interstitial (heart failure, renal failure) (Cho dan Atwood, 2002) sehingga
cairan mengalami filtrasi (keluar dari capillary)
dan berpindah ke ruang interstitial. Peningkatan volume dan akumulasi cairan di
interstitial menyebabkan terjadinya edema interstitial (Scallan et al., 2010).
Gambar
3. Gambaran mekanisme edema. Terdapat factor-factor yang mempengaruhi
pembentukan edema termasuk tekanan hydrostatic interstitial dan vascular serta
tekanan oncotic interstitial dan plasma. Peningkatan permeabilitas capillary berperan
penting dalam pergerakan osmotic secara aktif antara ruang intravascular dan
interstitial sehingga mempengaruhi akumulasi cairan di interstitial (Cho dan
Atwood, 2002).
Coma
dan kematian (bila terlambat diketahui dan diobati)
(Cote, 2014)
Perubahan Patologi:
Perubahan
Patologi Klinis dari pemeriksaan darah seperti:
- Erythrogram seperti: penurunanan PVC % dan jumlah eritrosit (RBC), peningkatan konsentrasi Hb dan MCHC yang menandakan terjadinya hemolytic anemia (Salem et al., 2010)
- Leukogram seperti leukocytosis, neutrophilia, lymphopenia, monocytosis. Namun paparan paracetomol pada dosis tinggi pada waktu yang lama pada anjing dapat menyebabkan leukopenia yang berhubungan dengan terjadinya perubahan pada bone marrow (hypocellularity) sebagai akibat penurunan produksi erythropoietin dari gangguan fungsi renal (Salem et al., 2010) dimana renal merupakan jaringan yang terdampak langsung akibat kelukaan oksidatif oleh toksisitas metabolit paracetamol NAPQI.
- Methemoglobinemia, lebih sering pada kucing dibandingkan anjing. Anjing akan mengalami methemogolinemia bila mengingesti paracetamol dalam dosis yang tinggi atau overdosis (Corrie, 2014). Level methemoglobin meningkatakan sekitar 2-4 jam selanjutnya diikuti terbentuknya Heinz bodi pada kucing (Richardson, 2000). Methemoglobinemia terjadi akibat adanya kelukaan oksidatif pada ion besi dari hemoglobin eritrosit menyebabkan perubahan ferrous iron (Fe2+) menjadi ferric iron (Fe3+). Ferrous iron hemoglobin (Hb Fe2+) yang teroksidatif akan berubah menjadi methemoglobin (metHb-Fe3+). Ferrous iron hemoglobin memiliki kemampuan untuk mengangkut oksigen secara reversible (HbFe2+ + O2 <-> HbFe2+ -O2), sedangkan methemoglobin tidak bisa mengangkut oksigen (Engelking, 2010). Kondisi methemoglobinemia ini menyebabkan terjadinya hypoxia, dyspneic (sulit bernafas), warna darah menjadi lebih kecoklatan, membrane mukosa menjadi cyanotic, serta disfungsi jantung dan pulmo (Cotter, 2001).
Gambar 4. Perbandingan darah kucing normal
dan yang mengalami toksisitas paracetamol.Test tube darah normal kucing (A) dan
yang mengalami toksisitas paracetamol (B) (darah berwarna coklat karena adanya
methemoglobin) (gambar oleh Hébert)
- Preparat apus darah: Heinz bodies adalah hasil presipitasi hemoglobin yang teroksidasi (Rebar, 2001). Kelukaaan oksidatif pada eritrosit menyebabkan pembentukkan Heinz bodies (struktur yang terbentuk dari perubahan atau distorsi membrane eritrosit). Heinz bodies terbentuk akibat oksidasi grup sulfhydryl (SH) dari hemoglobin serta presipitasi globin. Struktur ini terbentuk 24 jam setelah terpapar toksin. Kelukaaan oksidatif pada membran eritrosit ini bersifat irreversible (Cotter, 2001; Engelking, 2010). Pada kucing kemampuan untuk mengeliminasi Heinz bodies dari eritrosit oleh limpa (lien) adalah rendah sehingga terlihat gambaran inclusi pada darah kucing terutama pada kasus anemia Heinz bodies yang disebabkan oleh toksisitas paracetamol (Engelking, 2010). Heinz body dapat memperpendek survive eritrosit (Christopher et al., 1990) serta hemolysis (Cotter, 2001; Salem et al., 2010). Heinz bodies dapat dilihat melalui pewarnaan apus darah (peripheral blood smear) dengan pengecatan wright-giemsa atau pengecatan new methylene blue.
Gambar
5. Gambaran heinz body pada kucing akibat toksisitas paracetamol. Heinz bodies
dapat dilihat melalui pewarnaan apus darah (peripheral
blood smear) dengan pengecatan wright-giemsa berupa inclusi tunggal
berbentuk bulat dan berwarna pink dan colorless
pada sisi tepi (outside) membrane
eritrosit (A) serta dapat dilihat dengan pewarnaan New Methylene Blue akan
berwarna biru yang lebih pekat pada sisi tepi membrane eritrosit (B)(eClinpath,
2013).
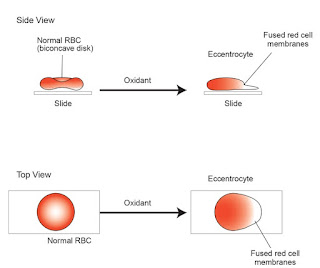
- Preparat apus darah: Eccentrocytes, umum ditemukan pada kondisi anemia hemolytic Heinz body. Eccentrocytes adalah eritrosit dengan bagian central yang memucat dimana hemoglobin terkonsentrasi pada satu kutup sel sedangkan pada kutup yang lain terlihat sebagai sitoplasma yang tidak terwarna, dan bila membrane eritrosit mengalami oksidasi terjadi fusi pada membrane pada sisi yang berlawanan sehingga mendorong hemoglobin ke peripheral (Rebar, 2001).
Gambar
7. Gambaran eccentrocytes anemia akibat toksisitas paracetamol (Sharkey, 2015)
Pemeriksaan Urine:
urine berwarna gelap akibat methemoglubinuria (Allen, 2013)
Gambar
8. Gambaran darah kucing yang mengalami toksisitas paracetamol. Syringe berisi
urine berwarna coklat (methemoglobinuria) (Allen, 2013).
Pemeriksaan
Serum.
Berdasarkan
Salem et al. (2010) pada anjing yang
mengalami toksisitas paracetamol akan menunjukkan:
- peningkatan enzim hepatic seperti ALT, ALP, dan GGT akibat adanya kerusakan sel-sel liver
- peningkatan konsentrasi bilirubin akibat terjadi peningkatan kerusakan eritrosit
- peningkatan BUN dan creatinine akibat adanya kerusakan sel-sel ginjal (renal)
Pemeriksaan
Ultrasonograhic
(USG): Pemeriksaan USG dilakukan untuk mengetahui perubahan
pada daerah liver, lien dan ginjal yang diduga mengalami toksisitas
paracetamol, terutama bila terjadi indiksi rasa sakit saat palpasi di daerah
abdominal - liver. Hasil dari intensitas gelombang yang dipantulkan oleh USG
memberi visualisai berupa warna putih (echoic) dan warna hitam (anechoic). Pada
kondisi normal, hasil USG pada liver menunjukkan: parenchyma liver bersifat homogenous hypoechoic (abu-abu hitam)
dan dinding vena portal bersifat echogenic
(putih). Pada kasus toksisitas paracetomol terjadi peningkatan echogenicity parenchyma liver (menjadi
lebih terang) dan penurunan atau hilangnya echogenic
dinding vena portal (menjadi lebih gelap). Peningkatan echogenicity pada
parenchyma liver menandakan adanya kerusakan hepar dimana sel-sel digantikan
oleh jaringan ikat (fibrous connective
tissue) (Salem et al., 2010).
Gambar
9. Hasil USG pada daerah abdominal anjing normal (A) dan toksisitas paracetamol pada anjing (B). Dibandingkan dengan kondisi normal, pada kondisi toksisitas
paracetamol terjadi peningkatan echogenicity pada parenchyma liver (L) yang
menandakan adanya kerusakan hepar dimana sel-sel digantikan oleh jaringan ikat
(fibrous connective tissue). Batas pengamatan: empedu (GB, gall bladder)
(anechoic; hitam) dan diafragma (D) (hyperechoic; putih) (Salem et al., 2010).
Pemeriksaan
Histopatologi. Pemeriksaan
histopatologi bisa dilakukan untuk mendapatkan data lebih lengkap untuk
mengetahui pathogenesis penyakit dan penegakan diagnose pada hewan yang telah
mati. Perubahan histopatologi pada anjing yang mengalami toksisitas paracetamol
berdasarkan Salem et al. (2010)
yaitu:
Gambar
10. Perbandingan gambaran histologi liver anjing pada kondisi normal (A) dan
yang mengalami toksisitas paracetamol (B - G). Gambar A menunjukkan gambaran
liver normal dengan hepatocyte berbentuk polyhedral dengan nucleus berbentuk
bulat. Gambar B menunjukkan terjadinya perubahan vacuolar. Gambar C menunjukkan
degenerasi hepatocyte. Gambar D menunjukkan pembengkakan hepatocyte disertai
kongesti tractus portal (portal tract).
Gambar E menunjukkan kongesti disertai disasosiasi parenchyma hepatic. Gambar F
menunjukkan kongesti pembuluh darah portal dan hyperplasia ductus empedu (bile duct). Gambar G menunjukkan
kongesti tractus portal (portal tract)
(Salem et al., 2010).
Gambar
11. Perbandingan gambaran histologi lien anjing pada kondisi normal (A) dan
yang mengalami toksisitas paracetamol (B - E). Gambar A menunjukkan gambaran
lien normal dengan jumlah lumphocyte yang tinggi. Gambar B menunjukkan
hyperplasia dengan peningkatan jumlah makrofag dan sel plasma. Gambar C
menunjukkan penebalan septa splenic (splenic
septae). Gambar D menunjukkan kongesti disertai vasculitis. Gambar E
menunjukkan penebalan septa fibrosa (fibrous
septae) (Salem et al., 2010).
Gambar
12. Perbandingan gambaran histologi ginjal anjing pada kondisi normal (A - C)
dan yang mengalami toksisitas paracetamol (D - I). Gambar A menunjukkan
gambaran ginjal normal dengan sel-sel epithelial renal berbentuk bulat dengan
nucleus eccentric. Gambar B menunjukkan glomerulus normal. Gambar C menunjukkan sel-sel tubular renal normal.
Gambar D menunjukkan vacuolasi (vacuolation) dan degenerasi epithelium tubular.
Gambar E menunjukkan degenerasi tubular disertai debris amorphous berwarna biru
gelap. Gambar F menunjukkan kongesti disertai vasculitis. Gambar G menunjukkan
perinephritis berupa penebalan kapsula renal (renal capsule). Gambar H
menunjukkan vacuolasi epithelium glomerulus, kongesti dan fibrosa pada
perivascular. Gambar I menunjukkan degenerasi disertai vacuolasi pada beberapa
epithelium tubular dan necrosis (Salem et
al., 2010).
Gambar
13. Perbandingan gambaran histologi bone
marrow anjing pada kondisi normal (A) dan yang mengalami toksisitas
paracetamol (B - C). Gambar A menunjukkan gambaran cellularity normal. Gambar B
menunjukkan tahapan sedang dari hypocellularity. Gambar C menunjukkan tahapan parah
dari hypocellularity (Salem et al.,
2010).
TREATMENT
Penanganan
atau pengobatan pada hewan yang didiagosa mengalami toksisitas paracetamol
harus dilakukan dengan sesegera mungkin. Decontaminasi toksin dari hewan sangat
penting dilakukan secepat mungkin (muntah atau dengan pemberian active charcoal). Jika
penanganan dapat dilakukan kurang dari 14 jam post ingesti obat, maka prognosis masih dapat bersifat fausta
(Cote, 2014).
Prosedur
penanganan toksisitas paracetamol:
- tempatkan hewan pada ruangan dengan udara yang bersih dan ventilasi yang terbuka (Corrie, 2014)
- berikan oksigen tambahan, koleksi darah dan urin untuk uji laboratorium (Corrie, 2014)
- terapi isotonic crystalloid fluid (infus seperti 0.9% saline atau NaCl fisiologis, Ringers’s lactate) untuk memulihkan kondisi tekanan darah dan perfusi darah (blood pressure and perfution) pada kondisi dehydrasi atau hypovolemia: 40-60 mL/kg/hari (Cote, 2014) atau untuk menjaga agar tetap hydrasi serta meningkatkan output urine (Corrie, 2014)
- decontaminasi toksin dari hewan dengan menginduksi emesis (namun jika hewan lemah tidak dibolehkan) atau pemberian terapi cairan (seperti saline), atau pemberian osmotic cathartic agents (untuk meningkatkan motilitas intestinal dan memicu pengeluaran feses) , atau dengan pemberian activated charcoal (adsorbent) 1-3 g/kg per oral (untuk anak kucing dan anak anjing 1-3 mg/kg) diulang tiap 3-4 jam sekali, namun bila dilakukan pemberian N-acetylcysteine maka tunda pemberian activated charcoal dengan jeda waktu pemberian diantara ke-2 obat tersebut sekitar 2-3 jam (Richardson, 2000; Cote, 2014; Corrie, 2014)
- Pemberian antidote: N-acetylcysteine (NAC). N-acetylcystein merupakan sumber sulfhydryl yang mengikat NAPQI, berfungsi mengembalikan keadaan methemoglobinemia menjadi normal, serta NAC juga bersifat sebagai prescursor glutation sehingga melindungi hepatocytes dan eritrosit. (Omer dan McKnight, 1980; Richardson, 2000; Cote, 2014). N-acetylcysteine biasanya tersedia dalam bentuk serbuk atau tablet sehingga harus dilarutkan menjadi konsentrasi 5-10% dengan saline atau Ringer’s lactate (secara infus) dilengkapi dengan 0.2 micron bacteriostatic filter untuk menjaga agar larutan yang masuk ke pembuluh darah dalam keadaan steril. Dosis awal pemberian pada anjing 280 mg/kg, pada kucing 140 mg/kg i.v dengan kecepatan infus yang lambat (constant rate infusion, CRI). Dosis lanjutan NAC yaitu 70 mg/kg p.o. q 6 jam untuk 5 kali pemberian atau 100 mg/kg q 24 jam. (Litte, 2001; Pothiappan et al., 2014; Cote, 2014).
- Alternative selain NAC yaitu sodium sulfate 50 mg/kg dengan konsentrasi larutan 1.6% secara i.v q 6 jam sebanyak 4 kali treatment atau hingga menunjukkan hasil positif (Corrie, 2014). Selain itu, ada referensi yang mengatakan pemberian methylene blue juga dapat digunakan untuk treatment methemoglobinemia dan meningkatkan hemoglobin eritrosi, dengan dosis 1-1.5 mg/kg q 4 jam sebanyak 2 kali (Litte, 2001; Rumbeiha dan Oehme, 1992). Namun ada referensi yang mengatakan pemberian methylene blue juga beresiko menginduksi pembentukan methemoglobin sehingga perlu dihindari (Steenbergen, 2003; Corrie, 2014).
- Pemberian ascorbic acid, berfungsi sebagai antioksidant, melindungi liver dan eritrosit dengan cara menangkap atau menetralkan toksin (ascorbate, vitamin C) 20 – 30 mg/kg p.o, im, iv (infus) q 8 jam untuk 2-3 kali sehari (BID-QID) ((Richardson, 2000; Cote, 2014)
- S-adenosylmethionine sebagai hepatoprotective, meningkatkan glutation sebagai antioxidant (Webb et al., 2003) dengan dosis dosis 18 mg/kg p.o (Khan et al., 2014) atau pemberian sediaan 90 mg p.o untuk kucing atau anjing kecil q 24 jam, hingga dosis 225 mg p.o untk anijng ukuran besar q 24 jam hingga 2 minggu hingga enzim liver kembali normal (Cote, 2014)
- Cimetidine, bersifat sebagai antagonist pada reseptor H2 dan menghambat enzim CYP 450 sehingga menurunkan metabolit NAPQI. Dosis penggunaan yaitu 5-10 mg/kg p.o, i.m, i.v q 6-8 jam (hanya untuk anjing) dan kontraindikasi pada kucing karena penggunaan pada kucing dapat menginduksi metabolit paracetamol (Cote, 2014; Khan et al., 2014)
- Transfuse darah bila dibutuhkan (Litte, 2001)
- Diet: pemenuhan kebutuhan protein dan kalori harus mencukupi, jangan bataskan diet protein kecuali terjadi hepatic encephalopathy. Untuk diet gunakan non-meat protein seperti keju (cottage cheese) dan telur (Cote, 2014)
- Perhatikan interaksi obat, seperti penggunaan phenobarbital dapat meningkatkan enzim CYP450 sehingga meningkatkan NAPQI (Cote, 2014)
- Monitoring: hematocrit, methemoglobin, level enzyme liver, total bilirubin (Omer dan McKnight, 1980; Cote, 2014)
DAFTAR PUSTAKA
Allen, A.L., 2003. The
diagnosis of acetaminophen toxicosis in a cat. Can. Vet. J., 44: 509-510.
Aronson L.R. dan
Drobatz.1996.,Acetaminophen toxicosis in 17 cats. J. Vet. Emerg. Crit. Care, 6:65–69
Aronoff, D.M., Oates,
J.A., dan Boutaud, O., 2006. New insights into mechanism of action of
acetaminophen: Its clinical pharmacologic characteristics reflect its
inhibition of the two prostaglandin H2 synthases. Clin. Pharmacol.Ther., 79:9-19.
Botting, R.M., 2000.
Mechanism of action acetaminophen: Is there a cyclooxygenase 3?. Clinical Infectious Disease, 31:8202-10.
Center,
S.A., 2015. Hepatic disease in small animals.
http://www.merckvetmanual.com/mvm/digestive_system/hepatic_disease_in_small_animals/other_serum_biochemical_measures_in_hepatic_disease_in_small_animals.html
Cho, S., dan Atwood, J.
E., 2002. Peripheral Edema. Am. J. Med.,
113:580-586
Christ, B., dan
Brückner, S., 2012. Rodent animal models for surrogate analysis of cell therapy
in acute liver failure. Frontiers in
Physiology, 3(78):1-9
Christopher, M.M.,
White, J.G., dan Eaton, J.W., 1990. Erytrocyte pathology and mechanisms of Heinz
body-mediated hemolysis in cats. Vet
Pathol., 27:299-310.
Court, M.H., 2013.
Feline drug metabolism and disposition: pharmacokinetic evidence for species
differences and molecular mechanism. Vet.
Clin. North Am. Small Anim. Pract., 43(5) doi:10.1016/j.cvsm.2013.05.002.
Cote,
B., 2014. Clinical Veterinary Advisor: Dogs and Cats, Elsevier Health Sciences.
Corrie, 2014. NSAID
toxicity in cats and dogs. https://s3.amazonaws.com/EliteCME_WebSite_2013/f/pdf/VFL02NSI14.pdf
Cotter,
S., 2001. Ch.18 oxidative injury to red cells. Hematology. Teton NewMedia.
Page:36
Engelking,
L.R., 2010. Erythrocytic Protection from O2 Toxicity, Chapter 30
dalam Textbook of Veterinary Physiological Chemistry, Updated 2/e, Academic
Press pp. 167 – 170
eClinpath,
2013. Heinz body hemolytic anemia in a cat with acetaminophen toxicosis.
http://www.eclinpath.com/hematology/morphologic-features/red-blood-cells/rbc-inclusions/heinz-body-hemolytic-anemia-in-cat-with-acetaminophen-toxicosis/
Fisher,
D. J., 1997. Disorders of Red Blood
Cells. Handbook of Small Animal Practice, 3rd Edition. Saunders, Philadelphia;
656-673
Hébert, P., Methemoglobinemia.
https://www.medvet.umontreal.ca/servicediagnostic/materiel_pedagogique/hematologie/methemo/methemo_en.html
Jancova, P., Anzenbacher, P., dan Anzenbacherova, E.,
2010. Phase II drug metabolizing enzymes. Biomed.
Pap. Med. Fac. Univ. Palaky Olomouc Czech Repub., 154(2):103-116
Jerzsele,
A., 2012. Comparative veterinary pharmacokinetics. http://cdn.intechopen.com/pdfs-wm/35674.pdf
Khan, S.A., 2014. Toxicities from human drugs, dalam
Toxicology. http://www.merckvetmanual.com/mvm/toxicology/toxicities_from_human_drugs/analgesics_toxicity.html
Litte,
S., 2011. The cat: clinical medicine and management. Elsevier Health Sciences.
Nash, S.L., Savides, M.C., Oehme,
F.W., dan Johnson, D.E., 1984. The effect of acetaminophen on methemoglobin and
blood glutathione parameters in the cats. Toxicology, 31(3-4):329-334.
Omer, St. W., dan
McKnight, ED III., 1980. Acetylcysteine for treatment of acetaminophen
toxicosis in the cat. J. AM. Vet. Med.
Assoc., 176(9):911-3.
Osweiler,
G., 1997. Household Drugs. The Handbook
of Small Animal Practice, 3rd Edition, Churchill, Livingstone, New York:
1279-1283; 1997.
Perry,
H., 1998. Acetaminophen. Clinical Management of Poisoning and Overdoses.
Clinical Management of Poisoning and Drug Overdose, 3rd ed. W.B. Saunders
Company, Philadelphia; 88-198
Pothiappan. P.,
Muthuramalingam, T., Sureshkumar, R., Selvakumar, G., Thangapandiyan, M., dan
Rao, G.D., 2014. Paracetamol poisoning in ac cat and its treatment. Ind. J. Vet. Sci. Res., 43(5): 388-389.
Rebar, A., 2001. A guide to
hematology in dogs and cats. Teton NewMedia.
Richardson,
J.A., 2000. Management of acetaminophen and ibuprofen toxicoses in dogs and
cats. Journal of Veterinary Emergency and
Critical Care, 10(4):285-291.
Rossoff,
I.S., 1994. Handbook of Veterinary Drugs and Chemicals, Pharmatox Publishing
Company, Taylorville, Illinois, USA.
Rumbeiha, W.K., dan
Oehme, F.W., 1992. Methylene blue can be used to treat methemoglobinemia in
cats without inducing Heinz body hemolytic anemia. Veterinary and Human Toxicology, 34(2):120-122
Salem, S.I., Elgayed,
S.S.A., El-Kelany, W.M., dan Abd El-Baky, A.A., 2010. Diagnostic Studies on
Acetaminophen toxicosis in Dogs. Global
Veterinaria, 5(2): 72-83.
Scallan, J., Huxley, V.H., Korthuis, R. J., 2010. Capillary Fluid Exchange: Regulation,
Functions, and Pathology. San Rafael (CA): Morgan & Claypool Life Sciences;
Chapter 4, Pathophysiology of Edema Formation. Available
from: http://www.ncbi.nlm.nih.gov/books/NBK53445/
Sharkey,
L., 2015. In clinical hematology: the blood
film review, 2015. 5(4).
http://todaysveterinarypractice.navc.com/in-clinic-hematology-the-blood-film-review/
Steenbergen,
V., 2003. Acetaminophen and cats – a dangerous combination, Veterinary Technician, 24(1).
Siroka, Z., dan
Svobodova, Z., 2013. The toxicity and adverse effect of selected drugs in
animals – overview. Polish Journal of
Veterinary Sciences, 16(1):181-191
Webb. C.B., Twedt,
D.C., Fettman, M.J., dan Mason, G., 2003. S-adenosylmethionine (SAMe) in a
feline acetaminophen model of oxidative injury. J. Feline Med. Surg., 5(2): 69-75
Weis,
S.M., 2008. Vascular permeability in cardiovascular disease and cancer. Curr. Opin. Hematol., 15(3):243-249.